检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 6165金沙总站官方入口 / 学术科研
鼻咽癌(Nasopharyngeal carcinoma, NPC)是一种跟遗传、环境等多因素相关的恶性肿瘤,在中国南方、东南亚等地区发病率较高[1]。由于在我国广东地区鼻咽癌发病率远高于全国平均水平,因此NPC也被称为“广东癌”[2,3]。EBV(Epstein-Barr virus)病毒感染是鼻咽癌的主要致癌因素之一,并在其发生进展过程中扮演了重要的角色[4]。前期研究多数基于整块组织或细胞系样本,无法精细和清晰的呈现肿瘤内部的异质性。尤其对于鼻咽癌内部肿瘤细胞、EBV和肿瘤微环境(tumour microenvironment, TME)细胞之间的相互作用,缺乏全面系统的认识。
针对此科学研究问题,来自北京大学生物医学前沿创新中心(BIOPIC)、6165cc金沙总站检测中心白凡研究员团队与中山大学肿瘤防治中心曾木圣/钟茜教授团队开展合作研究,研究团队使用最新的单细胞转录组测序技术(scRNA-seq),结合大样本基因组、转录组和临床数据,以及流式检测、多重免疫组化、免疫荧光、CCK-8、ELISPOT、小鼠移植瘤、细胞共培养等多种实验手段,对鼻咽癌肿瘤微环境进行了全面系统的剖析研究,并鉴别出一类独特的“上皮-免疫”双重特征肿瘤细胞亚群。研究论文“Single-cell transcriptomic analysis defines the interplay between tumor cells, virus infection, and the microenvironment in nasopharyngeal carcinoma”于2020年9月8日,以research article形式在线发表于著名学术期刊Cell Research。
在这项研究工作中,研究人员首先利用Smart-seq2和10x Genomics两种单细胞转录组技术平台对19个EBV+ NPC患者的肿瘤样本(其中3例有配对转移位组织),以及7例非肿瘤患者的鼻咽组织样本应用scRNA-seq技术,共捕获到大约104,000个单细胞(图1)。经过深入的生物信息学分析,研究人员在单细胞水平全面系统的描绘了肿瘤细胞、EBV、间质和免疫细胞等的转录组图谱。同时,研究人员在单细胞水平揭示了NPC肿瘤内部异质性,以及原位和转移位肿瘤组织潜在的播散关系。对EBV基因表达图谱特征分析表明,EBV潜伏期和裂解期基因可在宿主同一肿瘤细胞内共表达。
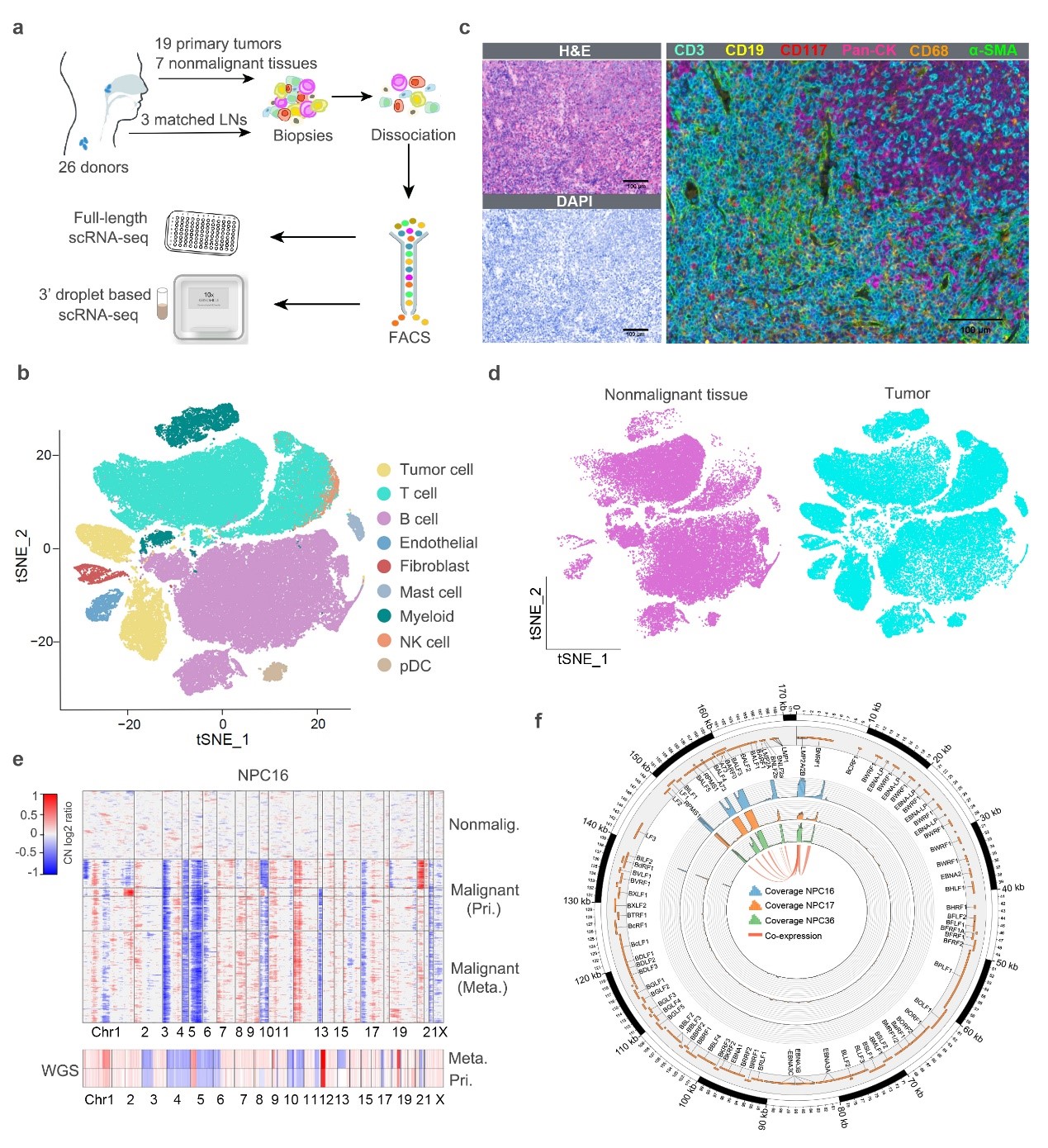
图1,整体实验设计及来自26个样本的约104,000个单细胞表达谱概况
值得注意的是,研究人员通过对肿瘤单细胞转录组数据应用非负矩阵因子分解(non-negative matrix factorization,NMF)方法解析其潜在的差异基因程序,鉴定出一种特殊的肿瘤细胞特异的“上皮-免疫”双重特征,既肿瘤细胞既表达经典的上皮细胞标志物(如EpCAM),又表达一些免疫标志物(如MHC-II类分子,补体基因等)。研究人员进一步结合免疫组化和bulk-RNA数据分析,证实这种双重特征的肿瘤细胞在鼻咽癌样本中广泛存在,并且跟较差的临床预后紧密联系。研究者通过体外细胞系和小鼠移植瘤模型等功能实验,揭示出具有该“上皮-免疫”双重特征的肿瘤细胞展现出较强的成瘤能力(图2)。
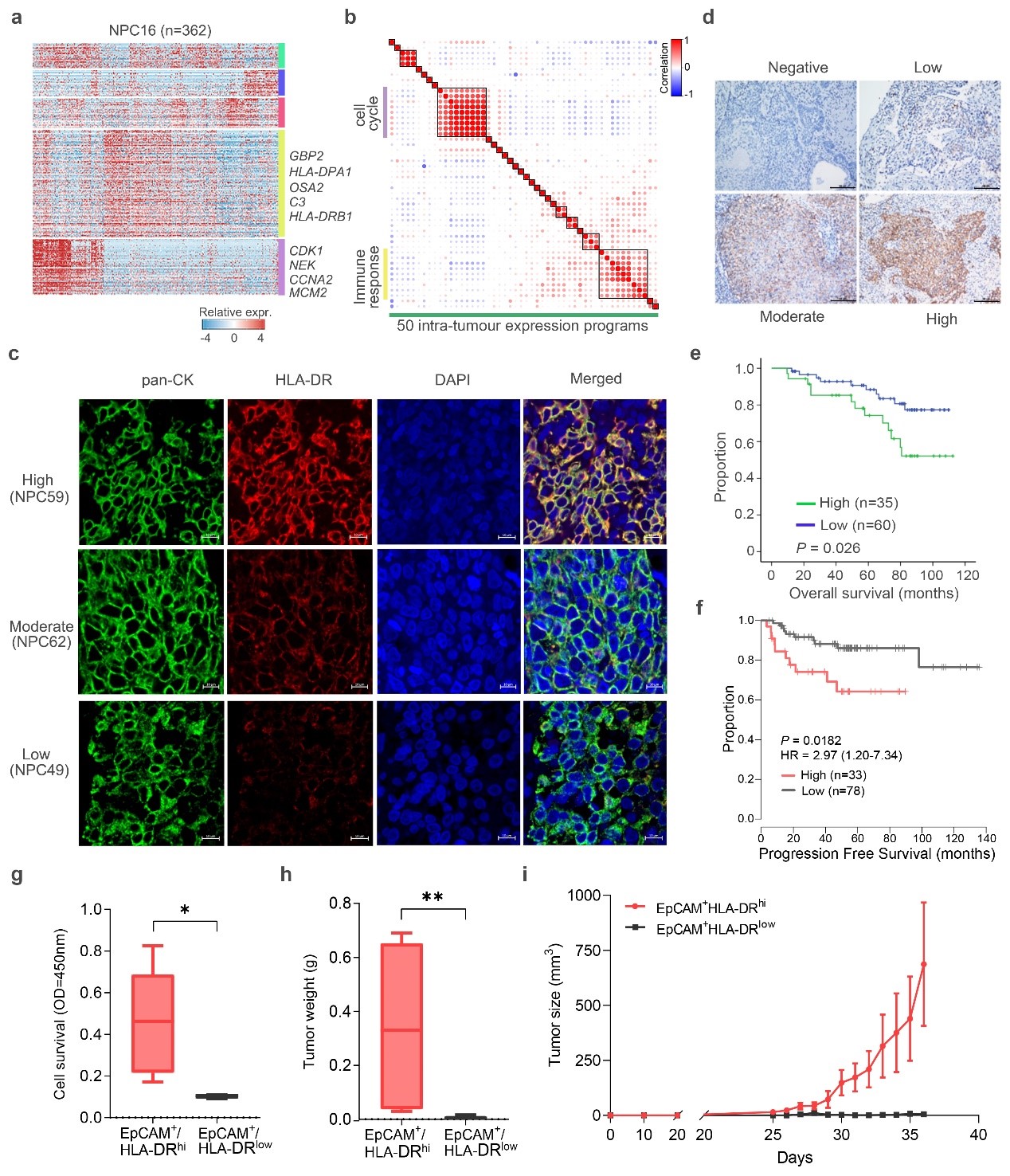
图2,单细胞水平发现鼻咽癌肿瘤细胞独特的“上皮-免疫”双重特征亚群,该亚群在鼻咽癌样本中广泛存在并与临床较差预后相关
接下来,研究人员通过单细胞转录组分析,全面刻画了鼻咽癌与非肿瘤鼻咽组织免疫微环境中的T细胞分群、转录状态和免疫激活/耐受情况(图3),以及髓系细胞分群、转录状态和发育轨迹。
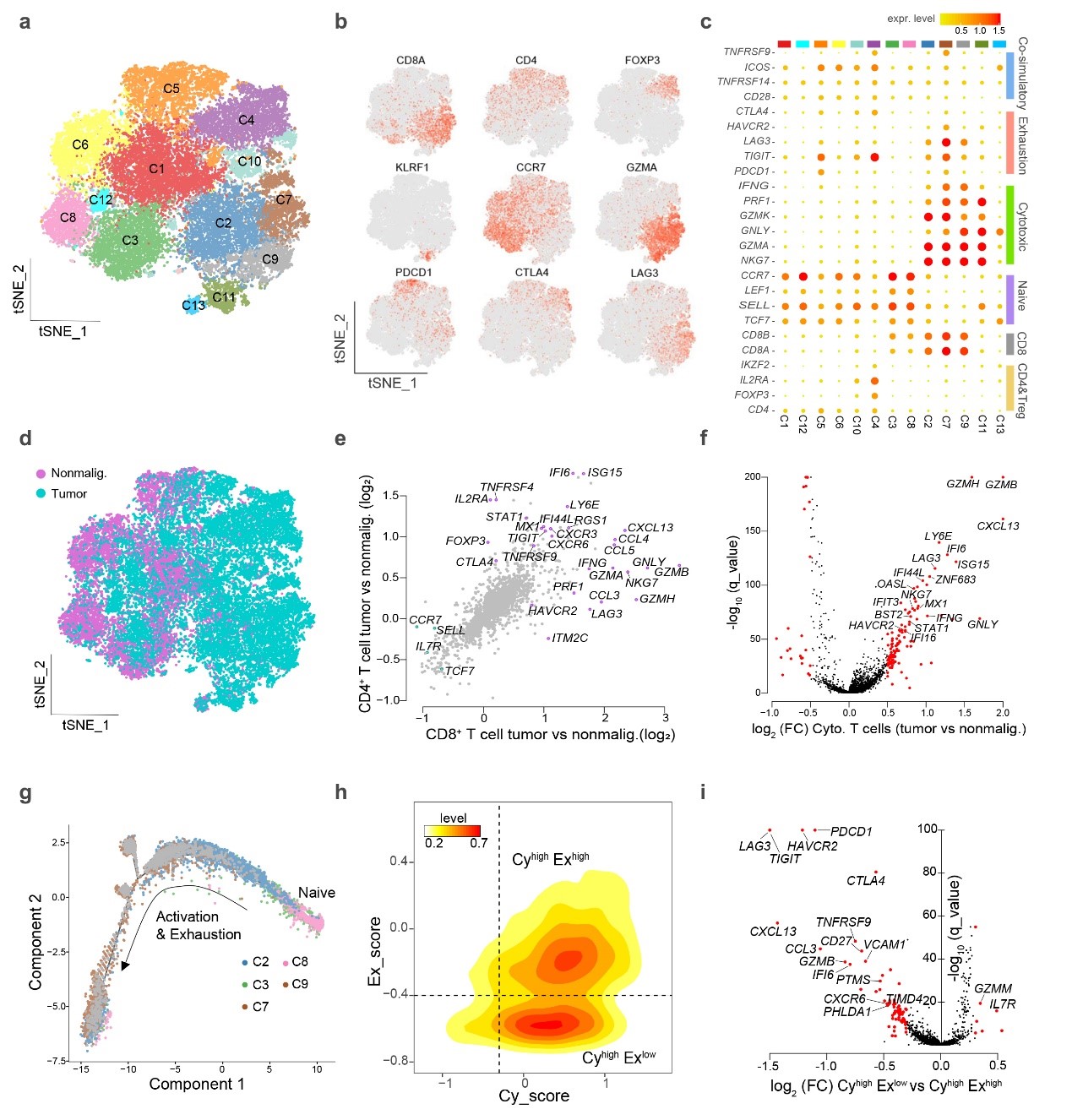
图3,单细胞水平刻画鼻咽癌与非肿瘤鼻咽组织免疫微环境中的T细胞分群、转录状态和免疫激活/耐受情况
通过计算IFN-α 和IFN-γ表达分值,比较肿瘤来源与非肿瘤来源细胞的各类型细胞IFN分值差异,研究人员发现NPC肿瘤微环境中主要细胞类型都有显著高的IFN-α 和IFN-γ分值,说明这种全局性干扰素响应上调普遍存在于NPC肿瘤微环境中。这个特征在其他肿瘤中尚未报道,可能反映了病毒感染与肿瘤细胞对肿瘤微环境的协同影响这一特质。
接下来,研究人员应用scRNA-seq数据的细胞特异性标记物,对140例未经治疗的鼻咽癌原位肿瘤组织的bulk RNA-seq数据样本进行解析,根据这些基因在肿瘤微环境中的差异表达特征,将其分为G1-G5共5组亚型。结合这些数据样本的病例临床信息,对它们的生存预后关系进行了组别分析比较。结果表明,该分子分型方法为NPC患者临床预后提供了一种新的生物标记物(图4)。
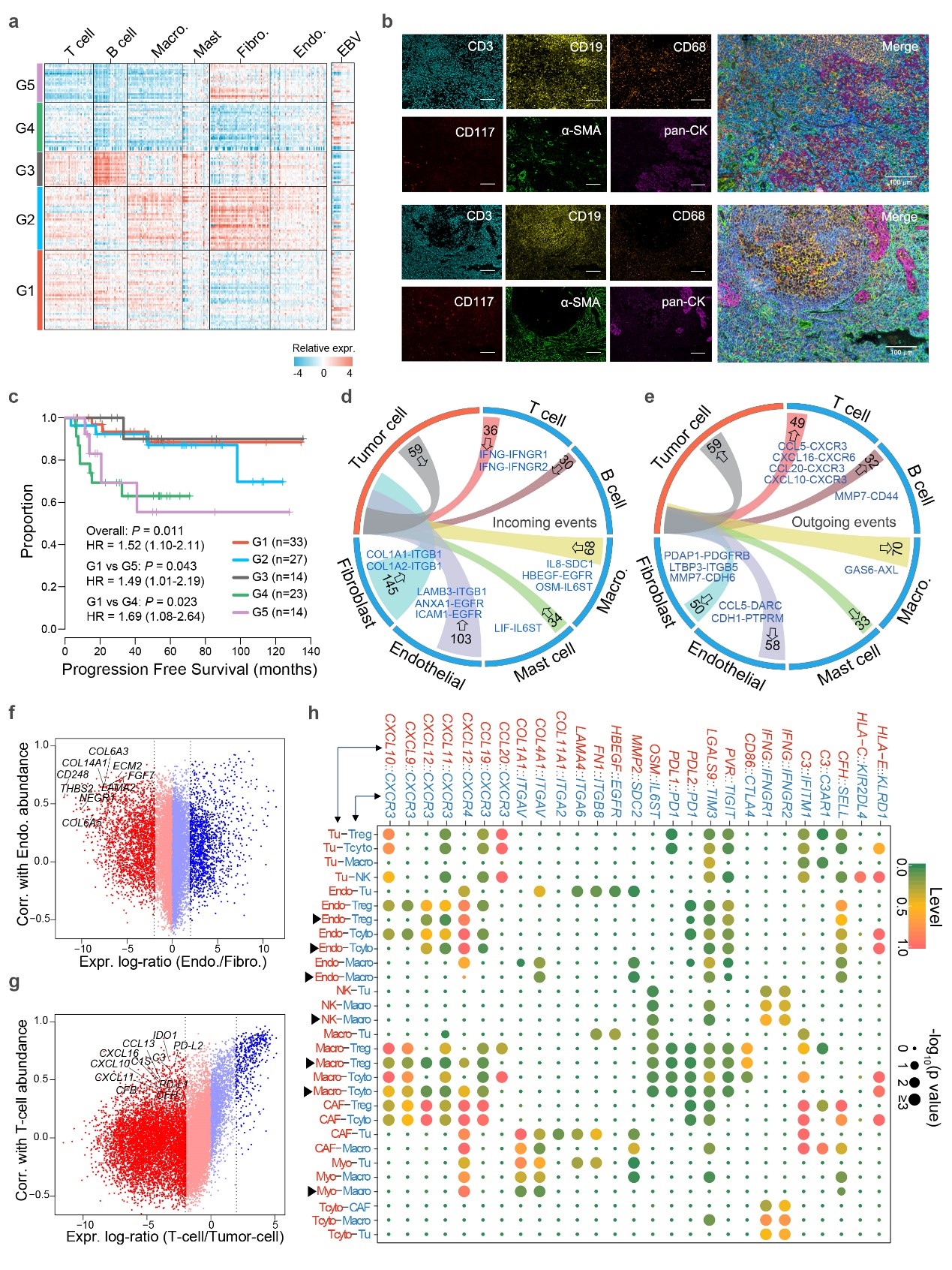
图4,单细胞数据分析发掘新的鼻咽癌免疫微环境预后分型模型及肿瘤细胞与免疫微环境细胞互作关系分析
最后,通过单细胞肿瘤细胞-免疫微环境互作分析,研究人员意外地发现“上皮-免疫”双重特征肿瘤细胞亚群对于免疫微环境中的T细胞存在更强的免疫抑制和调控功能。流式细胞实验分析证实了鼻咽癌免疫微环境中表达共抑制分子受体的浸润T细胞比例与“上皮-免疫”双重特征肿瘤细胞存在正相关性。进一步的共培养实验发现双重特征肿瘤细胞具有抑制CD8+ TILs分泌IFN-γ能力,这可能是造成肿瘤浸润T细胞耗竭的重要原因(图5)。
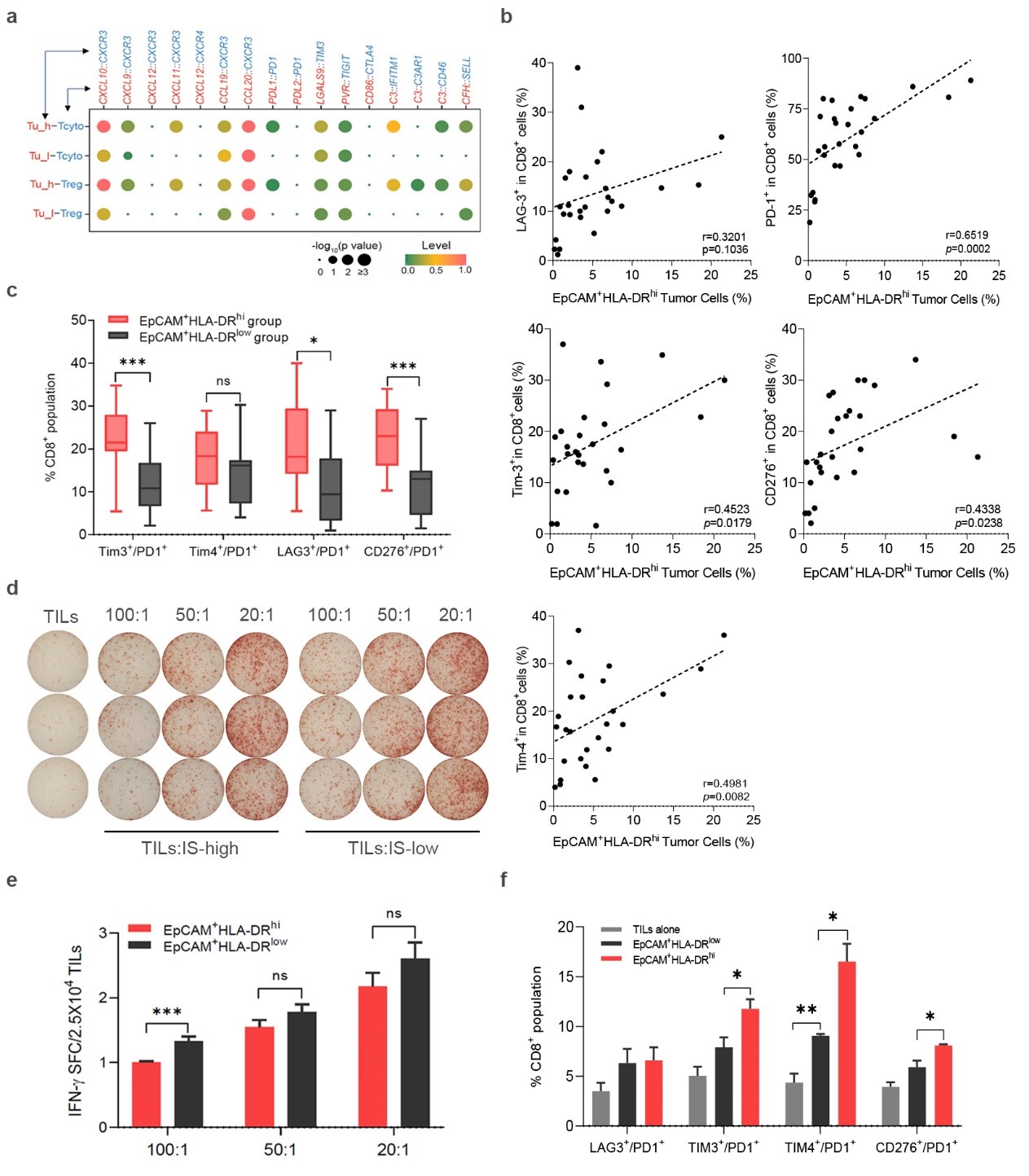
图5,“上皮-免疫”双重特征肿瘤细胞对于T细胞具有明显的抑制和调控功能
综上,该研究在单细胞水平全面呈现了鼻咽癌肿瘤微环境细胞组分和EBV表达图谱,同时解析了肿瘤细胞、EBV和TME非肿瘤细胞之间的互作关系,为研究NPC提供了很好的参考。特别是,本研究发现的“上皮-免疫”双重特征肿瘤细胞亚群,拓展了对于肿瘤细胞表型变化的全新认识。
北京大学生物医学前沿创新中心金善钊博士(已毕业)、博士后李若岩(现工作于英国Sanger Institute)和尉超(现工作于上海巴斯德研究所),中山大学肿瘤防治中心陈明远教授、唐林泉副主任医师为本文并列第一作者。中山大学肿瘤防治中心曾木圣教授、钟茜副研究员,以及北京大学生物医学前沿创新中心白凡研究员为本文共同通讯作者。哈佛医学院Brigham妇女医院Bo Zhao教授,Benjamin E. Gewurz教授,以及英国华威大学华威医学院Lawrence S. Young教授为本研究提供了重要指导。该研究项目同时得到了国家重点研发计划、国家科技重大专项、国家自然科学基金、广东省重点研发项目,以及广东省自然科学基金等的支持。
原文链接:https://www.nature.com/articles/s41422-020-00402-8
参考文献:
1. Lin, D.C., Meng, X., Hazawa, M., Nagata, Y., Varela, A.M., Xu, L., Sato, Y., Liu, L.Z., Ding, L.W., Sharma, A., et al. (2014). The genomic landscape of nasopharyngeal carcinoma. Nat Genet 46, 866-871.
2. Wei, W.I., and Sham, J.S.T. (2005). Nasopharyngeal carcinoma. The Lancet 365, 2041-2054.
3. Ho, C.S. (2017). Beating 'Guangdong cancer': a review and update on nasopharyngeal cancer. Hong Kong Med J 23, 497-502.
4. Chen, Y.P., Chan, A.T.C., Le, Q.T., Blanchard, P., Sun, Y., and Ma, J. (2019). Nasopharyngeal carcinoma. Lancet 394, 64-80.