检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 6165金沙总站官方入口 / 学术科研
2023年4月13日,6165cc金沙总站检测中心陆剑课题组在Molecular Biology and Evolution在线发表题为Adaptive evolution of the Spike protein in coronaviruses的论文,发现新冠病毒Spike(S)基因在持续演化以及冠状病毒长期演化过程中均受到强烈的正选择,但是正选择靶点则存在显著差异,揭示了冠状病毒S基因的演化规律。
冠状病毒是一种正义单链的RNA病毒,在自然界中广泛存在,分为Alpha,Beta,Gamma和Delta四个属,可以感染哺乳动物和鸟类等多个物种。目前已知有七种冠状病毒可以感染人类,包括当前正在流行的新冠病毒。冠状病毒的Spike(S)蛋白通过与宿主细胞表面的受体相互作用,促进病毒侵染细胞。S蛋白可以分为S1和S2区域,S1识别并与宿主细胞表面的受体结合,S2促进病毒与宿主细胞的膜融合。S1在决定宿主范围和组织嗜性方面起着至关重要的作用,可以进一步分为N端结构域(S1-NTD)和C端结构域(S1-CTD),两者都可以作为受体结合结构域(Receptor binding domain,RBD)与宿主受体结合。S蛋白还是宿主中和抗体的关键靶点。因此,病毒和宿主之间的演化军备竞赛(evolutionary arms race)将驱动S蛋白序列快速演化。
大多数冠状病毒的宿主为动物(图1a)。本研究对四个属的冠状病毒基因组序列进行了分子演化分析,发现S1-NTD在四个属的冠状病毒演化过程中存在明显的正选择信号。S1-NTD主要识别宿主细胞的糖受体,也可以识别宿主细胞的辅助蛋白,因此S1-NTD的正选择信号可能来自于受体使用的多样化,反映出冠状病毒在不断探测以适应不同宿主物种和组织的能力。此外,S1-NTD也可作为冠状病毒宿主生物抗体的中和表位,冠状病毒可能迅速演化以逃避宿主的免疫反应(图1a)。
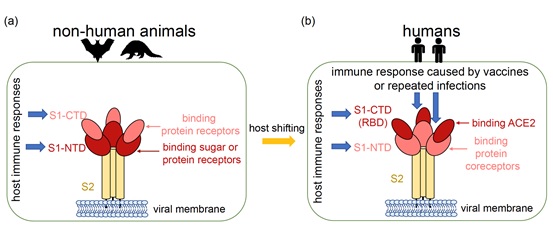
图1. SARS-CoV-2和其他冠状病毒之间S基因选择压力差异的模型 (Tang et al. 2023, MBE)
与冠状病毒S基因的长期演化趋势不同,本研究发现在新冠病毒的持续演化过程中,S基因的S1-CTD(RBD)受到了强烈的正选择。通过对各突变株基因组序列的比较,正选择信号主要集中在SARS-CoV-2的S1-CTD(RBD)区域,然而新冠病毒的S1-NTD区域并没有检测到正选择信号。研究推测可能是宿主环境的变化以及人类免疫反应的选择压力导致了新冠病毒与其他冠状病毒正选择靶点的变化(图1b)。此研究也印证了陆剑团队先前(2022年3月2号)与吴仲义|吕雪梅团队在Molecular Biology and Evolution发表的文章“The runaway evolution of SARS-CoV-2 leading to the highly evolved Delta strain”的观点,该研究认为随着新冠病毒感染人数的增加,病毒群体大小增加,提高适应性变异出现和固定的概率,加速适应性演化速率加快病毒的扩散,从而形成群体大小和演化速率之间的正反馈循环,导致高度演化变异株的快速涌现(图2)。这两项研究均表明感染人数的急剧增大是促进病毒变异加快的重要因素。
图2 新冠病毒感染人数与演化速率之间的正反馈 (Ruan et al. 2022, MBE)
综上所述,本研究发现S基因,特别是S1区域,在SARS-CoV-2和其他冠状病毒中都经历了强烈的正选择。虽然S1-NTD在所有四个冠状病毒属中都表现出正选择,但在SARS-CoV-2的持续演化中,主要在S1-CTD(RBD)中检测到正选择信号,这可能是由于宿主环境的改变以及人类群体大规模感染所产生的免疫压力所致。本研究有助于加深对病毒演化规律的理解,也为疫苗靶点的设计提供了参考。
陆剑教授为该研究的通讯作者,生科院博士后唐小鹿为第一作者,医科院病原所钱朝晖研究员和中科院昆明动物所吕雪梅研究员也为该工作做出了重要贡献。该工作得到了国家科技部、北京市自然科学基金委和6165cc金沙总站检测中心启东产业创新基金等的支持。
原文链接: https://doi.org/10.1093/molbev/msad089
原文链接: https://doi.org/10.1093/molbev/msac046