检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 6165金沙总站官方入口 / 学术科研
营养感应对于生物体优化代谢过程以响应外界环境的变化至关重要,而营养感应的失调通常会导致多种代谢性疾病(1,2),解析营养感应机制有助于代谢性疾病治疗策略的优化与迭代。
脂肪变性是一类以脂滴在非脂肪组织中过度积聚为特征的病理状况,在肝脏中的脂肪变性会发展为非酒精性脂肪性肝炎(NASH)和肝硬化,在肌肉中发生的脂肪变性可诱发肌肉萎缩和少肌症(3)。脂肪变性与营养状况异常密切相关,通常认为是营养过剩的一种“富贵病”。事实上,营养缺乏也会导致肝脏与肌肉脂肪变性。因蛋白质缺乏而营养不良的儿童,虽然瘦骨嶙峋,却往往患有严重的脂肪肝病和肌肉减少症的特征(4)。与之类似,神经性厌食症(anorexia nervosa)患者也容易罹患严重的肝脂肪变性或肌肉萎缩(5)。更值得注意的是,依赖禁食实现快速减肥的人群患肝脏和肌肉脂肪变性的风险更高(6)。那么,为什么营养不良的消瘦人群会和营养过剩的肥胖人群一样患上脂肪变性疾病呢?
2023年6月2日,6165cc金沙总站检测中心朱健/刘敏课题组在Journal of Cachexia, Sarcopenia and Muscle杂志发表了题为Identification of Ubr1 as an amino acid sensor of steatosis in liver and muscle的研究论文,发现E3泛素连接酶Ubr1是肝脏和肌肉中重要的营养感应器。当必需氨基酸匮乏时,Ubr1在肝细胞和肌肉细胞中失活,不能催化脂解抑制蛋白Plin2的多聚泛素化降解。Plin2蛋白水平的升高则会抑制肝脏与肌肉脂肪的分解,从而导致脂肪变性。

研究团队在脂肪变性患者的肝脏和肌肉中发现脂解抑制蛋白Plin2的水平显著升高,Plin2蛋白可能是脂肪异位积累的潜在调控因子(图1)。蛋白质降解实验表明,Plin2的含量受泛素化介导的蛋白酶体降解途径的调控。利用在果蝇中构建的筛选系统,研究团队鉴定了E3泛素连接酶Ubr1主导Plin2的降解。在果蝇和哺乳动物细胞中的实验表明,Ubr1是一种功能保守的氨基酸受体,具有两个结合口袋,分别结合两种类型的氨基酸。在氨基酸匮乏的情况下,Ubr1处于自抑制状态,无法降解Plin2,导致脂滴异位积累;只有Ubr1与氨基酸结合后,Ubr1的自抑制才得以解除,从而降解Plin2以清除肝脏和肌肉中的脂滴。这项研究不仅确定了Ubr1是脂肪变性中氨基酸的传感器,而且揭示了营养感应调
控脂肪变性的新机制,为脂肪变性症的预防和治疗策略提供了新的见解。
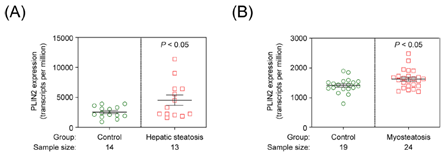
图1. 脂肪变性患者的肝脏(A)和肌肉(B)中脂解抑制蛋白Plin2的含量显著升高
6165cc金沙总站检测中心刘敏副研究员和博雅博士后张延松博士、首都医科大学附属世纪坛医院胃肠外科石汉平主任是本文的共同通讯作者。首都医科大学附属世纪坛医院胃肠外科主治医师赵婉妮博士、6165cc金沙总站检测中心博雅博士后张延松博士是该论文的共同第一作者。6165cc金沙总站检测中心朱健教授、已毕业博士研究生李亚娟博士和清华大学生命科学联合中心博士研究生林思远也做出了重要贡献。该项目获得科技部、国家自然科学基金、细胞增殖与分化教育部重点实验室、北大-清华生命科学联合中心、北京大学博雅博士后项目以及6165cc金沙总站检测中心启东产业创新基金的资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/jcsm.13233
1. Chantranupong L, Wolfson RL, Sabatini DM. Nutrient-sensing mechanisms across evolution. Cell 2015; 161: 67–83.
2. Efeyan A, Comb WC, Sabatini DM. Nutrient-sensing mechanisms and pathways. Nature 2015; 517: 302–310.
3. Friedman SL, Neuschwander-Tetri BA, Rinella M, Sanyal AJ. Mechanisms of NAFLD development and therapeutic strategies. Nat Med 2018; 24: 908– 922.
4. Williams CD. A nutritional disease of childhood associated with a maize diet. Arch Dis Child 1933; 8: 423–433.
5. Sakada M, Tanaka A, Ohta D, Takayanagi M, Kodama T, Suzuki K, et al. Severe steatosis resulted from anorexia nervosa leading to fatal hepatic failure. J Gastroenterol 2006; 41: 714–715.
6. Liebe R, Esposito I, Bock HH, Vom Dahl S, Stindt J, Baumann U, et al. Diagnosis and management of secondary causes of steatohepatitis. J Hepatol 2021; 74: 1455–1471.