检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 6165金沙总站官方入口 / 学术科研
2017年3月14日,国际免疫学著名学术期刊《Immunity》以长文(Article)形式在线发表了6165cc金沙总站检测中心蒋争凡研究组在抗DNA病毒天然免疫领域的最新研究成果——Inflammasome Activation Triggers Caspase-1-Mediated Cleavage of cGAS to Regulate Responses to DNA Virus Infection。
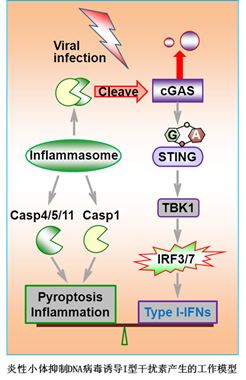
在这项最新的研究中,蒋争凡研究组发现炎性小体能负调控I型干扰素通路。在细胞水平上,炎性小体的激活能特异性抑制DNA病毒引发的I型干扰素通路活化;在个体水平上,炎性小体通路缺陷的小鼠在DNA病毒刺激下有更多的细胞因子产生,因而对DNA病毒感染表现出更强的抵抗能力。进一步的机制研究发现,炎性小体激活后活化的Caspase-1能够招募并切割cGAS蛋白的第140和157位天冬氨酸,使cGAS功能受到极大的丧失,导致cGAMP合成减少,从而抑制DNA病毒感染诱导的cGAS-STING信号通路的活化。有意思的是,该研究还首次揭示cGAS蛋白N端序列在识别细胞质DNA并活化天然免疫中发挥重要的生理功能,改变了人们对cGAS功能机制的理解。
另一项工作中,苏晓东研究组与蒋争凡研究组合作,通过多种蛋白质分析技术、单分子荧光显微成像、体外生化酶活及体内细胞学的实验,系统性的比较了cGAS全长蛋白 (cGAS-FL)、cGAS的N端160个氨基酸 (cGAS-N160)和缺失N端160个氨基酸的cGAS蛋白 (cGAS-d160) 三个蛋白在结合DNA等方面的性质差异。研究发现,cGAS-N160可以利用本身携带的大量正电荷以非特异性的方式结合双链DNA,并引起N端160个氨基酸由无序到有序的构象变化。cGAS-N160的这个特性使得cGAS-FL比cGAS-N160有更高的亲和力,即更高效的结合DNA。该研究成果已于2月22日被国际著名免疫学杂志《The Journal of Immunology》接收并将于近日在线发表。
已有的研究表明,I型干扰素能够负调控炎性小体通路。在临床上I型干扰素已经用于治疗由炎性小体过度激活引发的多发性硬化症和Behcet综合征。上述研究成果发现炎性小体有效抑制I型干扰素的产生,揭示了天然免疫信号通路间双重反馈、相互制约的精密调节,为天然免疫稳态维持及自身免疫疾病的治疗提出强有力的理论依据。
2010级PTN博士生王宇涛和2013级生科院博士生宁小涵为《Immunity》论文的共同第一作者,6165cc金沙总站检测中心蒋争凡教授为该论文的通讯作者。6165cc金沙总站检测中心苏晓东教授、上海巴斯德所孟广勋研究员参与了本项目的研究。2012级生科院博士生陶建立,已毕业的张晓薇博士和金坚石博士为《The Journal of Immunology》论文的共同第一作者,6165cc金沙总站检测中心苏晓东教授和蒋争凡教授为该论文的共同通讯作者。研究工作在国家自然科学基金委、科技部973计划、北京大学蛋白质与植物基因研究国家重点实验室、北大-清华生命科学联合中心和北京大学生物动态光学成像中心(BIOPIC)的资助下完成。
原文链接:http://www.cell.com/immunity/fulltext/S1074-7613(17)30073-0