检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 6165金沙总站官方入口 / 学术科研
2016年11月8日,6165cc金沙总站检测中心生物动态光学成像中心汤富酬课题组与北医三院乔杰课题组合作在《Cell Research》杂志上在线发表了题为“DNA methylation and chromatin accessibility profiling of mouse and human fetal germ cells”的研究论文,首次系统地解析了人类与小鼠胚胎期生殖细胞中染色质开放程度和基因组DNA甲基化的动态变化及其与基因表达的关系。
哺乳动物的生殖细胞是非常重要的一类特殊细胞类型,汤富酬课题组与乔杰课题组紧密合作,通过流式细胞分离技术(FACS)和免疫磁珠细胞分离技术(MACS)结合单细胞转录组高通量测序技术以及少量细胞DNA甲基化组高通量测序技术,系统、全面地揭示了人类原始生殖细胞在多个关键发育阶段的DNA甲基化组重编程过程、及其对基因表达的调控关系,相关研究成果以封面文章的形式发表在2015年《Cell》杂志上,发现人类原始生殖细胞在受精后10-11周的胚胎中,其甲基化水平达到最低点,下降到6-7%(中位数值),但是其基因表达网络基本维持稳定,由此推测DNA甲基化组重编程过程中DNA甲基化与转录调控已经脱扣,而早期生殖细胞中的染色质开放程度对于基因转录调控可能起了更为关键的作用(Guo et al.Cell, 2015)。
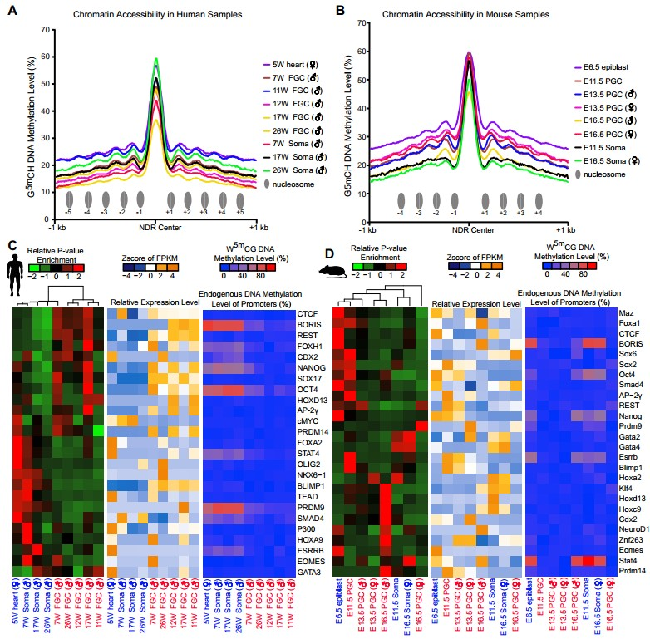
图1 人类和小鼠生殖细胞中关键基因的表达、远端染色质开放区域状态、以及转录因子结合位点的富集模式
然而标准的在全基因组水平研究细胞染色质状态的方法需要用到大量细胞,很难在人类胚胎期生殖细胞这种稀少的材料中进行研究。在此项研究中两个课题组采用优化的NOMe-seq(全基因组核小体定位及DNA甲基化组测序)技术,同时分析了细胞的染色质状态组和内源DNA甲基化组的动态变化,再结合转录组测序,系统、深入地分析了人类早期生殖细胞多个关键发育阶段的染色质状态组以及DNA甲基化组的重编程过程,及其对基因表达的调控关系。同时也对相应发育阶段的小鼠早期生殖细胞进行了NOMe-seq分析,发现了人类和小鼠早期生殖细胞染色质状态组、DNA甲基化组与基因表达调控的进化保守性特征和物种特异性特征。通过此项研究,研究人员发现:(1)分别在人类和小鼠早期生殖细胞中鉴定出了116,887和137,557个染色质开放区域(也叫核小体缺失区域,nucleosome-depleted regions (NDRs)),其中84,834个(人类)和109,264个(小鼠)为远离转录起始位点的染色质开放区域。这些大部分是候选增强子元件,为该领域提供了一个丰富、精准的关键染色质调控区域的数据集;(2)在人类和小鼠早期生殖细胞中远离转录起始位点的染色质开放区域强烈富集多能性干细胞以及生殖细胞特异性转录因子的结合位点,比如人类的OCT4, NANOG, SOX17,小鼠的Oct4, Nanog, Sox2等转录因子的结合位点,说明这些关键转录因子对于维持生殖细胞特异的基因表达网络起了重要的调控作用。特别是SOX17的调控序列只在人类早期生殖细胞NDR区域特异性富集,而Sox2的调控序列只在小鼠早期生殖细胞NDR区域特异性富集。相应的SOX17特异性地在人类早期生殖细胞中表达,而Sox2特异性地在小鼠早期生殖细胞中表达,反映了早期生殖细胞中SOX家族转录因子的表达和靶基因调控的物种特异性特征;(3)SVA重复序列是人类等灵长类动物基因组高度富集的,而在小鼠基因组中很少。与周围的微环境体细胞相比,基因组中的SVA重复序列在人类早期生殖细胞中特异性地呈现更加开放的染色质状态,相应的SVA重复序列的转录本也在这些早期生殖细胞中特异性地高表达;(4)之前该课题组的研究报道了在人类着床前胚胎以及着床后的早期生殖细胞基因组DNA去甲基化过程中,年轻的重复序列(比如LINE-1和Alu)倾向于保留更多DNA甲基化修饰来抑制其转录活性(Guo et al.Nature, 2014; Guo et al.Cell, 2015),而在此项新研究中不仅验证了这一现象,而且更进一步发现在人类早期生殖细胞基因组DNA去甲基化过程中,这些年轻的重复序列倾向于维持关闭的染色质状态,保留更多的剩余DNA甲基化,以此共同抑制其转录和转座活动,从而维持生殖系细胞基因组的稳定性。
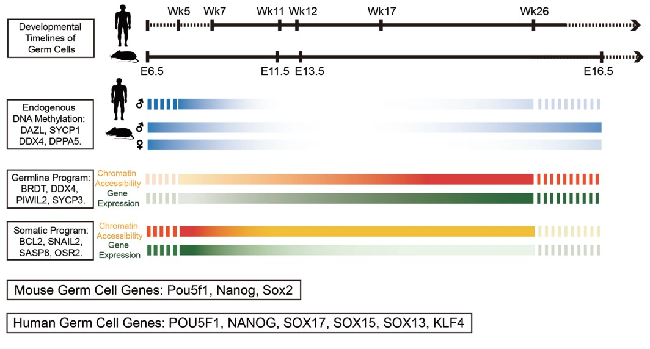
图2人类和小鼠胚胎期生殖细胞DNA甲基化组和染色质状态组的重编程过程,以及对应基因的表达变化
6165cc金沙总站检测中心郭红山博士,博士生胡博强,北医三院生殖中心闫丽盈博士和雍军博士为此文章的并列第一作者;6165cc金沙总站检测中心汤富酬研究员,北医三院乔杰教授为这篇文章的共同通讯作者。该项研究得到了国家自然科学基金、科技部973计划、北大清华生命科学联合中心、北京未来基因诊断高精尖创新中心的资助。
原文链接:http://www.nature.com/cr/journal/vaop/ncurrent/full/cr2016128a.html