检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 6165金沙总站官方入口 / 学术科研

2019年12月3日,《美国科学院院报》(PNAS)在线发表了6165cc金沙总站检测中心郑晓峰研究组的题为“Cellular redox sensor HSCARG negatively regulates the translesion synthesis pathway and exacerbates mammary tumorigenesis” 的长篇研究文章。该研究发现细胞氧化还原状态感受器蛋白HSCARG通过抑制PCNA的泛素化修饰阻断跨损伤DNA合成(TLS),进而加剧乳腺癌的发生发展,揭示了跨损伤DNA合成通路调控的新机制。
在DNA复制过程中,PCNA蛋白围绕 DNA形成环状三聚体以增强DNA合成的持续性,当复制叉被DNA损伤位点阻挡时,PCNA蛋白的泛素化修饰启动跨损伤DNA合成途径,这一修复途径的激活帮助细胞规避更为严重的DNA双链断裂的产生。
郑晓峰课题组发表在PNAS的研究鉴定了一个新的PCNA相互作用蛋白HSCARG。HSCARG能够增强USP1/UAF1复合体对PCNA的去泛素化活性,并进一步导致TLS通路的失活,双链断裂的形成和突变的累积。生物信息学分析以及免疫组化和乳腺癌模型小鼠相关表型实验结果一致表明,HSCARG在乳腺癌组织中存在着高表达现象,敲除内源的HSCARG能够减缓乳腺癌的自发形成。HSCARG本身在胞内的调控功能又受到细胞氧化还原状态的影响,当细胞在氧化压力下,HSCARG由二聚体解离为单体,由细胞质进入细胞核,上述变化增强了HSCARG对TLS通路的调控效率。
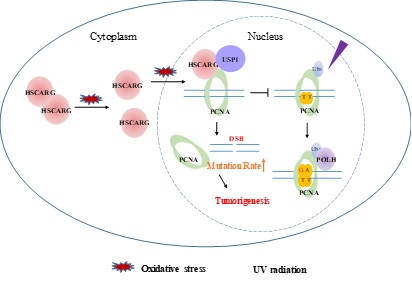
HSCARG调控跨损伤DNA合成应答模式图
此外,郑晓峰课题组2019年8月23日还在Nature Communications发表题为hCINAP regulates the DNA-damage response and mediates the resistance of acute myelocytic leukemia cells to therapy的研究论文,揭示hCINAP通过调控核磷蛋白NPM1的SUMO化修饰参与调控DNA损伤修复,在维持基因组稳定性中发挥重要作用。
DNA损伤应答机制(DNA damage response, DDR)在修复DNA损伤和维持基因组稳定性中具有重要作用。但另一方面,肿瘤细胞通过增强DNA损伤的修复能力来逃逸细胞死亡,从而导致肿瘤细胞对化放疗药物的耐受性。因此,DDR在疾病的预防和治疗中发挥着双刃剑的作用。鉴定新的能够参与肿瘤细胞DDR通路中的关键调控因子,并通过阻断调控通路来减弱肿瘤细胞对化放疗药物的耐受性,是提高肿瘤治疗效果的一个重要策略。
该研究在揭示hCINAP调控DDR的分子机制的基础上,发现在急性髓系白血病(acute myelocytic leukemia,AML)病人的外周血白细胞中,hCINAP表达量比正常人的外周血白细胞低。表明hCINAP的低表达会导致细胞基因组不稳定,更易促进肿瘤的发生发展。此外,还构建了人源肿瘤异种移植AML小鼠模型,用hCINAP敲低的恶性白血病细胞移植到AML小鼠尾静脉中,追踪观察AML小鼠的疾病发展和对化疗药物的耐药性,并且进行生存曲线分析。发现在AML小鼠中进一步敲低恶性白细胞中hCINAP蛋白的表达,可以增强化疗药物的治疗效果,有助于小鼠AML疾病的治疗。
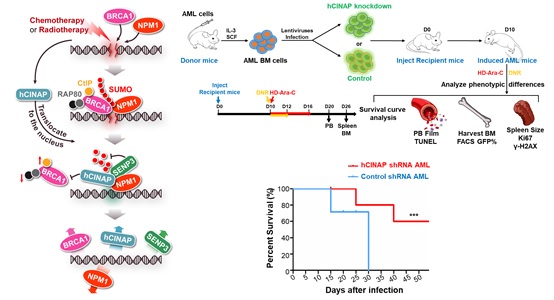
hCINAP参与调控DDR的分子机制及其对AML白细胞耐药性的影响
北京大学郑晓峰课题组的博士研究生臧维成为PNAS论文第一作者,徐瑞丹为Nature Communications论文的第一作者。6165cc金沙总站检测中心郑晓峰教授为两篇文章的通讯作者。这些研究得到了国家科技部重点研发计划、国家自然科学基金重点项目、蛋白质与植物基因研究国家重点实验室、6165cc金沙总站检测中心以及6165cc金沙总站检测中心仪器中心的大力支持。
原文链接:
https://www.pnas.org/cgi/doi/10.1073/pnas.1910250116