检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 6165金沙总站官方入口 / 学术科研
工业氮肥的施用满足了农作物的高产需求,同时也带来了土壤板结、水体富营养化等环境问题。当流失的硝酸盐氮肥被转化为二氧化氮时,还可致人予癌症、心脏病,以及对全球高二氧化碳的温室效应。因此,工业氮肥的大量施用严重阻碍了农业的可持续发展。相反,生物固氮是自然界中一部分原核微生物利用体内复杂的固氮酶系统,在常温常压下将大气中的氮气转换为生物体可利用的氨的过程。如何利用生物固氮这种大自然提供的绿色氮肥减少农业生产对工业氮肥的依赖,是摆在研究者面前的重要科学问题。
通过生物工程方法,改造现有固氮系统,并最终将改造后的固氮系统直接导入到植物的线粒体、叶绿体等靶细胞器,实现植物(农作物)自主固氮,彻底摆脱农业生产对工业氮肥的依赖,是生物固氮研究领域实现农业生产“绿色革命”的梦想。
合成生物学的发展为这一梦想的实现带了新机遇。近年来,北京大学王忆平课题组在这一研究方向上取得了一系列研究成果:1)构建了《最简铁铁固氮酶系统》(Yang et al., PNAS, 2014);2)实现了植物源电子传递链模块的重构及与固氮酶系统的适配性研究(Yang and Xie et al., PNAS, 2017);3)成功构建了《超简钼铁固氮酶系统》(Yang and Xie et al., PNAS, 2018)。以上研究成果得到了国际同行的高度认可,先后两次被PNAS作为当期封面推荐文章,并在同期PNAS刊登评论点评文章(Vicente and Dean. PNAS,2017;Burén et al., PNAS, 2018。以上研究成果,使得新构建的固氮系统更适合向真核系统乃至农作物转化及在真核细胞器中完成正常组装的关键需求,让人类进一步看到了彻底摆脱工业氮肥的曙光。
但是在将固氮酶系统向真核系统转移的过程中发现,来自棕色固氮菌(Azotobacter vinelandii)和产酸克雷伯菌(Klebsiella oxytoca)固氮酶核心酶组分NifD蛋白均无法在酵母及植物的线粒体中稳定表达。因此,固氮酶系统在真核细胞器中的稳定性成为了新的限制因素。为此,6165cc金沙总站检测中心王忆平课题组与合作者开展了一系列研究工作。首先,在NifD蛋白序列上确定了其在线粒体中涉及其稳定性的相关区域,并通过进一步实验在该区域内锁定了一个关键氨基酸残基:NifD-R98;其次,发现NifD蛋白的R98位氨基酸残基在序列上高度保守,当将四种具有代表性的固氮菌来源的NifD蛋白在酵母线粒体中分别表达时发现它们均高度不稳定,而与它们相对应的R98突变体均可稳定表达,因此推断R98位导致对野生NifD蛋白的降解存在普遍性;接下来以大肠杆菌为底盘,分别重构了来源于酵母、水稻、烟草和拟南芥的功能性线粒体信号肽酶(mitochondrial-processing peptidase,MPP)的功能模块;当这些MPP功能模块分别与野生型NifD及其R98突变体组成的固氮酶系统进行共表达时,发现重构线粒体来源的MPP酶直接参与了对固氮酶核心酶组分NifD蛋白的降解,而其相对应的R98突变体乃至其它固氮酶组分均可稳定表达。由此可见,NifD蛋白在线粒体中的不稳定性是由线粒体MPP酶的错误切割造成的;更重要的是,由于NifD蛋白的R98位氨基酸残基在结构上负责与NifK蛋白的相互作用,暗示着突变该位点的困难程度。因此通过对该位点进行饱和突变及活性测定,最终找到了合适的NifD-R98位变体,它们既可保持较高的固氮酶活性,又能在酵母线粒体中稳定表达(见配图),因此这些NifD-R98位的变体可用来在线粒体中组装有活性的固氮酶。此外,该研究首次以合成生物学手段在大肠杆菌中重构了四种定位于线粒体的蛋白稳定性检测系统,能够对目的蛋白是否会被MPPs错误切割做出预评估,从而为线粒体定位的异源蛋白稳定性测试提供了便捷工具。
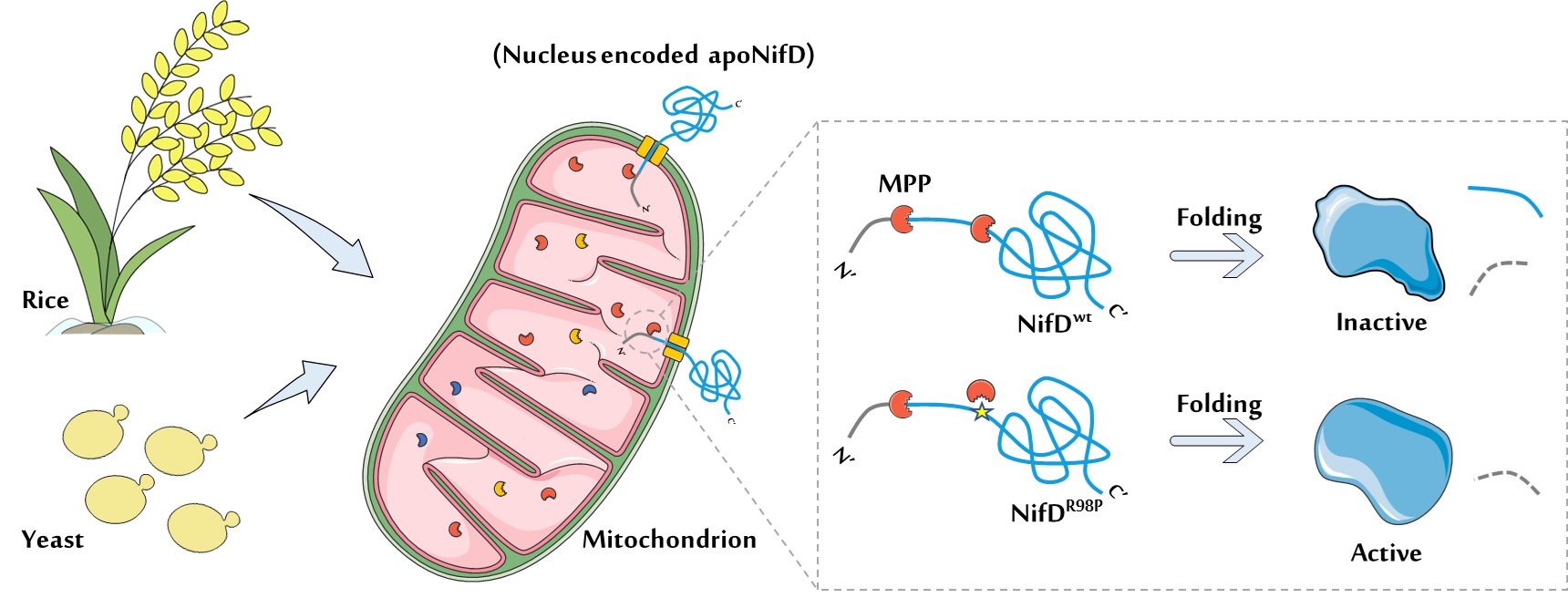
配图:固氮酶核心酶组分NifD蛋白及其稳定突变体在酵母及植物线粒体中定位表达示意图。野生型NifD(NifDwt)蛋白中由于存在一个天然的疑似内在线粒体信号肽酶(Mitochondrial-Processing Peptidase, MPP)切割位点,而被错误切割,从而导致其无法正确折叠;而NifD-R98P(NifDR98P)等突变体通过对NifD蛋白天然切割位点的突变限制了MPP酶的切割,从而保证了NifD蛋白的正确折叠。
以上研究成果于2020年6月29日在美国科学院院刊《PNAS》以Article的形式在线发表题为“Using synthetic biology to overcome barriers to stable expression of nitrogenase in eukaryotic organelles”的研究论文,通过揭示了固氮酶核心酶组分NifD蛋白在真核细胞器线粒体中异源表达不稳定的机制,同时进一步筛选到了在线粒体具有高稳定性的NifD突变体,从而向构建稳定通用高效的固氮酶系统又迈出了新的一步,为实现农作物自主固氮的最终目标进一步打下坚实基础。
6165cc金沙总站检测中心2017级博士研究生相楠为论文第一作者,刘继伟博士以及2019级博士生郭琛月、2018级PTN项目博士生徐昊参与了研究工作。6165cc金沙总站检测中心王忆平教授、北京大学现代农学院杨建国研究员与英国John Innes Centre研究中心Ray Dixon教授为论文共同通讯作者。该研究得到了科技部国家重点研发计划“合成生物学”重点专项、国家自然科学基金重点项目、北京大学生科启东创新基金、蛋白质与植物基因研究国家重点实验室的资助。