检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 6165金沙总站官方入口 / 学术科研
2021年4月6日,最新一期《美国科学院院报(PNAS)》发表了王世强教授实验室在长期研究冬眠适应机制的基础上提出的心脏钙信号分子调控理论:心肌特异性转录因子MyoCD通过SRF促进JPH2和CAV3基因的“协奏转录”和两种蛋白间相互作用,铆定肌质网与横管膜的纳米耦联结构,压缩横管钙通道与肌质网钙释放通道间信号转导的物理空间,提高兴奋收缩耦联的分子效率。这一发现揭示了心肌细胞钙信号和兴奋收缩耦联分子调控的基本原理。冬眠动物利用这一调控保证了深低体温条件下心脏仍具有强有力的泵血功能。
心肌细胞的横管膜与肌质网膜平行排列,二者之间的钙信号转导决定着心脏的收缩能力。王世强实验室以往研究发现,在心肌肥厚和心力衰竭等病理条件下,由于miR-24对JPH2表达的抑制,横管膜与肌质网膜脱耦联,由此造成的跨膜钙信号转导效率降低是心脏收缩力进行性下降的关键病理机制。如何提升横管-肌质网钙信号转导效率是该领域致力攻克的难题。
冬眠是多种小型哺乳类、鸟类动物适应寒冷缺食的冬季演化产生的节能行为。冬眠黄鼠可以象人一样保持37℃左右的恒定体温,但在冬季可以将体温降低到接近冰点的环境温度附近。一般哺乳动物的心脏在25-15℃出现严重心律失常并逐渐丧失收缩能力,但冬眠动物的心脏在深低体温下虽然心率减慢,但收缩愈发有力。王世强在早年的冬眠研究中发现,冬眠态黄鼠的心脏比清醒态黄鼠的心脏即使在相同实验温度下仍具有更强的收缩力,而兴奋期间的钙内流却是减弱的。这种兴奋收缩耦联效率增高的现象正是心力衰竭研究领域孜孜以求的目标。因此,阐明冬眠动物兴奋收缩耦联钙信号调控原理并应用于对心力衰竭的防治策略研究,成为王世强杰出青年科学基金提出的原创性科学命题,也为北京大学赢得了第一个NIH R01研究项目。
十多年来,从电生理到钙成像、从超微结构到基因表达、从多个基因顺式元件筛查到多种转录因子互作,王世强的博士生许师明、黎荣昌、杨磊、李祎晨、项斌、王礼鹏等克服了非模式动物研究的诸多制约因素,接力进行深入探索,终于揭示了冬眠动物赖以增强其兴奋收缩耦联效率的钙信号相关蛋白转录调控机制,提出了“MyoCD-JPH2调控轴”的系统理论。其中,JPH2和CAV3是在铆定肌质网和横管膜中发挥关键作用的一对互作蛋白,二者虽然分子序列迥异,但具有类似的类CArG顺式作用元件,并共用MyoCD-SRF转录机器(图1)。这一“协奏转录(concerted transcription)”新原理为保证互作蛋白的化学配比(stoichiometry)提供了优化方案。
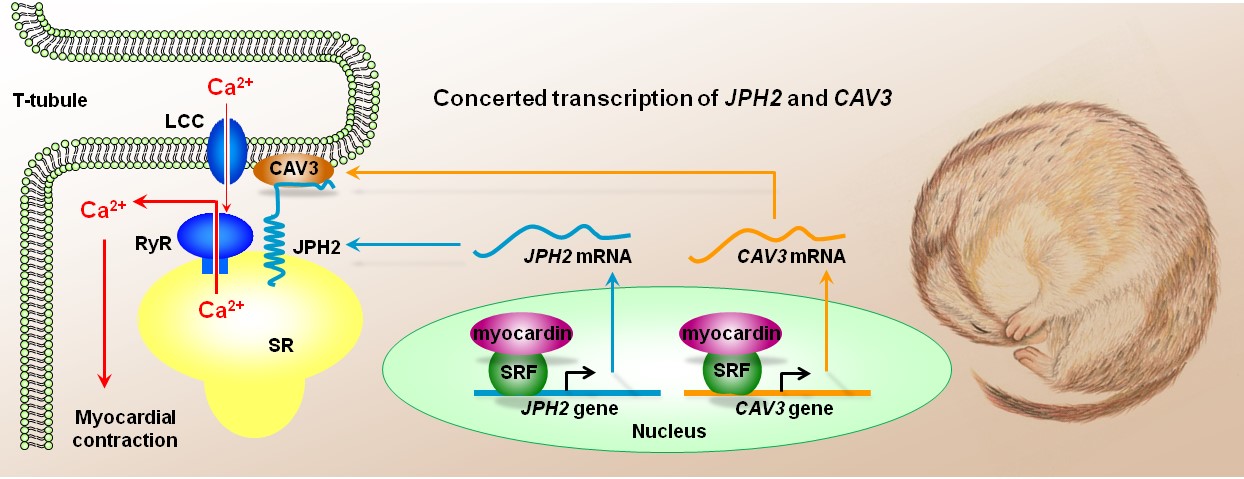
图1. 心肌细胞横管膜与肌质网膜钙信号转导的分子调控机制
我国的冬眠生理研究是著名生理学家赵以炳先生在抗战后回清华园重启科研时开创的。赵以炳先生于1952年院校调整时在北京大学创建了生理学教研室,冬眠研究遂成为北京大学传统的生理学研究课题,经历了七十年风风雨雨,一直是国际冬眠生理研究的主力团队之一。冬眠生理的两大核心问题一是如何调控体温,二是如何在深低体温下生存。上世纪八九十年代,蔡益鹏教授等在冬眠动物体温调节神经机制方面的研究受到国际关注。王世强是跟随周曾铨、高天礼教授参与冬眠动物耐低体温机制研究的,并在九十年代揭示了冬眠动物钙稳态适应性及其肌质网机制(也是我国最早用激光共聚焦显微术开展的细胞钙信号动态研究)。一代代学人的研究积累为后续深入研究冬眠调控分子机制提供了底蕴。
PNAS一文关于冬眠黄鼠兴奋收缩耦联钙信号调控原理的发现是王世强-柴真冬眠研究团队的最新成果,揭示了冬眠动物耐低体温生存的关键适应性机制。该文提出的“协奏转录”、“MyoCD-JPH2调控轴”等新概念、新理论虽然是在冬眠动物发现的,但代表了心肌细胞钙信号和兴奋收缩耦联调控的一般原理。该文在对比冬眠和心力衰竭不同的分子生理变化后提出了冬眠动物作为“反心衰模型”的研究价值,为相关心脏疾病的研究提供了新思路。
(全文链接:https://www.pnas.org/content/118/14/e2025333118)