检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
/ 6165金沙总站官方入口 / 学术科研
哺乳动物精子发生是一个高度复杂且受到严密调控的细胞发育过程。该过程包含三个最基本的生物学事件:有丝分裂、减数分裂和精子形成。在有丝分裂过程中,精原细胞经历自我更新、增殖和分化,保证了精子发生的持续性和稳定性;在减数分裂过程中,发生同源染色体的精准配对、重组交换与精确分离,在保证遗传稳定性的基础上产生了配子遗传物质的高度多样性;在精子形成过程中,则发生了顶体形成、组蛋白-鱼精蛋白转换、核浓缩和包装重建等一系列复杂的细胞生物学和形态学变化,使精子细胞具备了运动和受精潜能。上述过程中生精细胞类型的多样性和生物学事件的高度复杂性决定了精子发生是研究基因表达调控的绝佳模型。
然而,经过数十年的深入研究,目前对哺乳动物精子发生的研究仍然存在着许多制约因素。例如,目前尚未有高效和便捷的生精细胞体外培养体系,而且由于数十类生精细胞和多种体细胞同时存在于睾丸组织当中,要获取高纯度的、处于特定发育阶段的各级生精细胞是极其困难的。因此,当前对精子发生机制的研究多采用的是对类型混杂的群体细胞的系综平均研究,而非对单个性细胞直接进行系统研究。这也就导致长久以来我们对哺乳动物精子发生的调控机制缺乏一个系统全面的理解。
2018年7月30日,国际知名学术期刊《Cell Research》在线发表了北京大学汤富酬课题组与中国科学院生物化学与细胞生物学研究所童明汉课题组、李劲松课题组合作的题为Single-cell RNA-seq Uncovers Dynamic Processes and Critical Regulators in Mouse Spermatogenesis的最新研究成果。该工作开创性地将精子发生同步化方法与生殖细胞特异性荧光标记相结合,分离获取了高纯度的处于不同发育阶段的小鼠生精细胞,并应用高精度单细胞转录组测序的方法,建立了小鼠精子发生过程的转录组精细图谱。该工作系统揭示了精子发生过程中基因表达调控的动态变化,筛选、验证了不同发育阶段的关键调控因子,证实了不同发育阶段精子细胞与卵细胞结合后产生的胚胎具有不同的发育潜能,并系统地总结了精子发生过程中RNA可变剪接的动态变化、减数分裂性染色体失活(MSCI)等多种关键生物学事件的核心规律。
1. 精子发生同步化方法获得高纯度各级生精细胞的策略
精子发生是一个连续且非同步化的过程,表现为生精上皮的细胞组合存在周期性变化,沿生精小管纵轴方向的不同位置处于不同的生精上皮周期。睾丸内生精细胞类型的复杂性则源于生精上皮周期性释放的维甲酸信号——维甲酸为精原细胞分化的必需因子,精原细胞分化的不同步造成了不同生精上皮内生殖细胞组合的多样性。
基于精原细胞分化的机理,该研究通过对新生小鼠连续7天饲喂维甲酸合成通路的抑制剂WIN 18,446,使精子发生阻滞于未分化型精原细胞阶段,在第8天通过腹腔注射维甲酸,使精原细胞同步分化。由于分化后的细胞周期相对固定且同步,通过对维甲酸处理不同时间点的小鼠系列取材,可获得不同发育阶段的生精细胞。而未分化型精原细胞不受同步化的影响,为了避免其污染,该研究构建了生精细胞特异性携带红色荧光蛋白(Vasa-dTomato)的基因敲入小鼠模型和未分化型精原细胞特异性携带黄色荧光蛋白(Lin28-YFP)的基因敲入小鼠模型。红色单阳性的细胞即为同步化的目的细胞,可以通过单细胞采集系统Unipick获得单个细胞或FACS分选收集目的细胞群体。基于上述方法,该研究分离并鉴定了20类处于精子发生不同时期的细胞类型(图1),并利用高精度单细胞转录组测序的方法建立了上述不同发育阶段的转录组详细图谱。
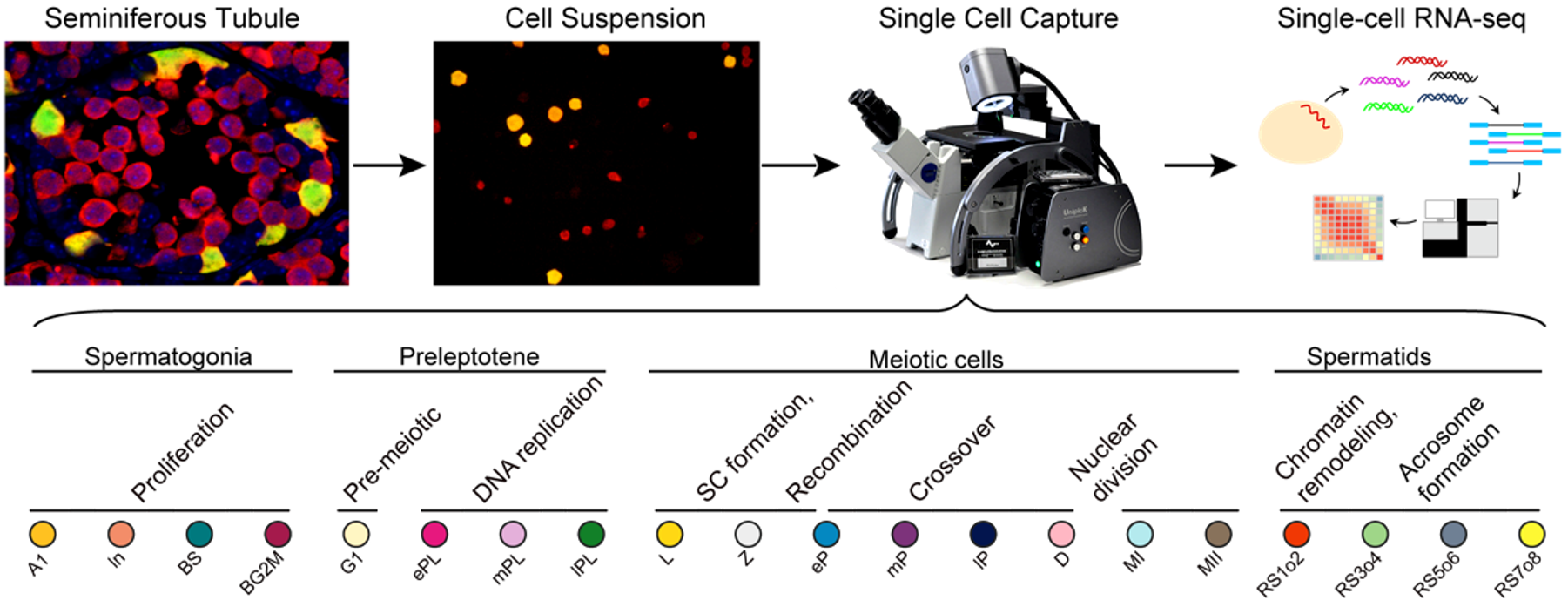
图1:研究流程示意图及该研究中的20种生精细胞类型
2. 生精细胞转录组的动态变化
通过对20个阶段的1,204个生精细胞进行高精度单细胞转录组测序,经过严格的质量控制后,剩余1,136个细胞用于后续的分析。基因表达数目结果显示,在整个精子发生过程中,生精细胞需要调动基因组近90%(20,088个基因中的18,037个)的蛋白质编码基因的表达(图2a);与此同时,各阶段生精细胞转录水平存在明显的动态变化。其中晚粗线期与双线期精母细胞达到整个精子发生过程的转录峰值,而在晚细线前期与细线期阶段则为转录低谷期(图2a)。聚类结果显示,20类生精细胞可以划分为7大类。有趣的是,同处于DNA复制的早细线前期与中晚期细线前期精母细胞被聚类到了不同的类群之中(C1与C2)(图2b),提示早细线前期(ePL)向中晚期细线前期(mPL)的转变可能是减数分裂过程潜在的重要转折点;同为圆形精子细胞的RS2(C5)、RS4与RS6(C6)和RS8(C7)则被分为三群,提示其功能可能存在显著差异。
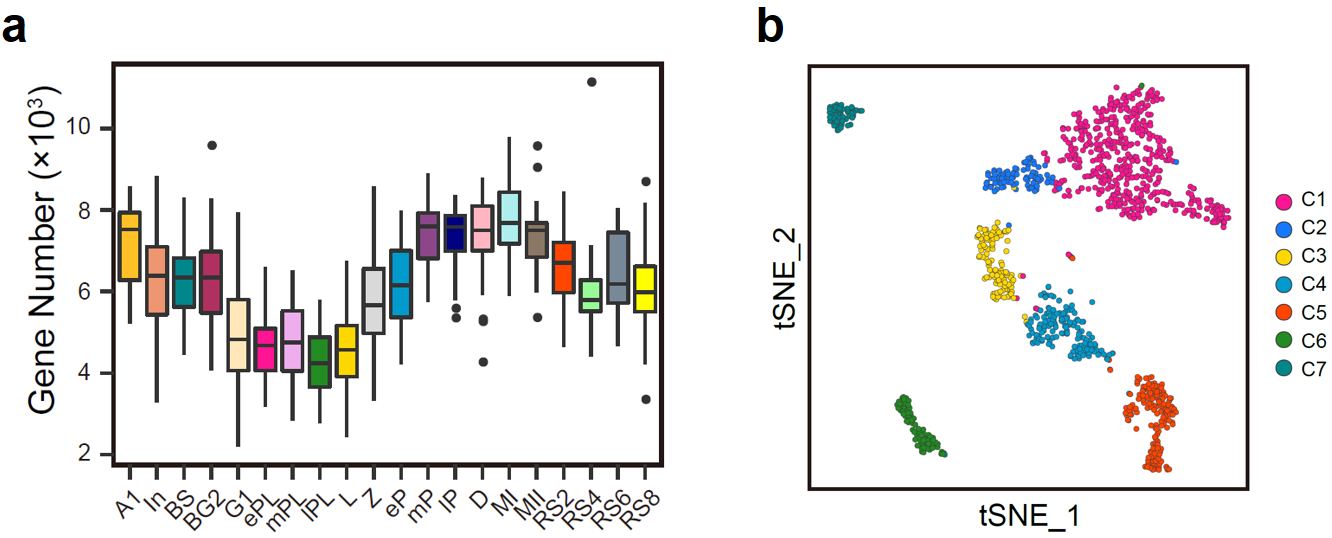
图2:(a)箱式图展示了20个阶段的生精细胞中已知蛋白质编码基因的基因数量;(b)t-SNE分析将生精细胞划分为C1至C7共7个新类群
3. 精子发生过程中关键调控因子的筛选与验证
参与减数分裂过程的新基因
减数分裂是生殖细胞所特有的生物学事件,是生物有性生殖的基础。在此过程中,同源染色体的非姐妹染色单体间发生配对、联会和重组交换,从而使配子呈现遗传多样化,增加了后代的适应性。如此复杂的生物学过程需要众多因子的共同协调,而在此之前已知的调控因子并不全面,有待进一步挖掘和阐明。
该研究通过系统的生物信息学的分析发现了与减数分裂重组过程相关的重要基因,包括Prdm9、Gm960、Meiob等,它们均特异表达于细线期或偶线期精母细胞内。与此同时,还发现了一些未知基因,包括Fbxo47、Pparg、Ccnb3等也表现出同样的表达模式。提示这些未知基因可能在减数分裂重组过程中发挥关键调控作用。
于是该研究选择了Fbxo47基因开展进一步的功能验证,此前的报道认为Fbxo47基因和人类癌症相关,但是其具体功能仍是未知。该研究构建了Fbxo47的条件性基因敲除小鼠,功能研究发现生精细胞内特异性失活Fbxo47基因的小鼠表现为雄性不育。睾丸切片H&E染色结果显示,Fbxo47基因敲除的成年小鼠的精子发生阻滞于生精上皮的第Ⅳ期,同时发生大量精母细胞凋亡的现象(图3a)。免疫荧光染色结果进一步显示,Fbxo47基因敲除的成年小鼠生精上皮内没有粗线期精母细胞及后续细胞类型,表现为减数分裂前期I停滞(图3b)。上述结果进一步证实了该研究建立的精子发生过程转录组精细图谱在筛选参与特定生物学事件的潜在调控因子的可靠性。
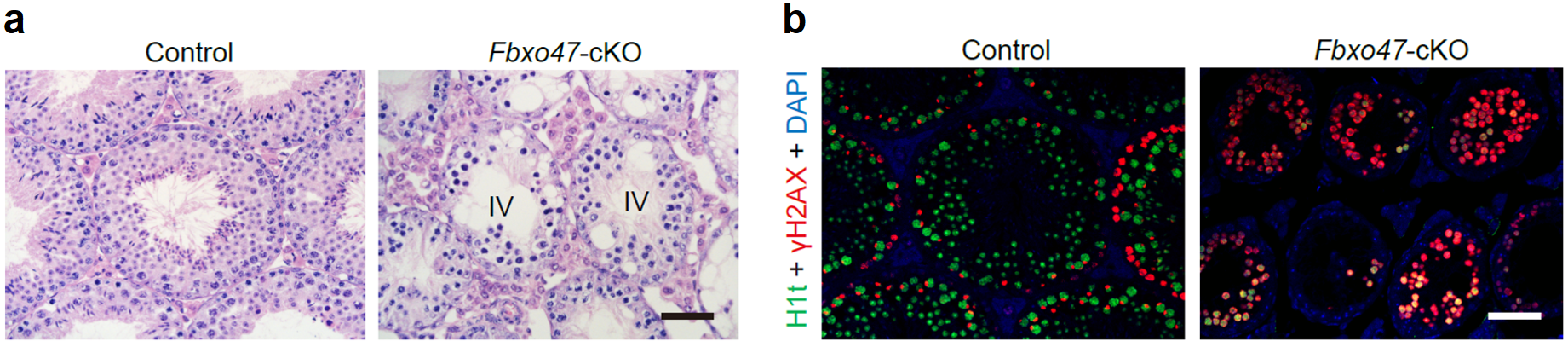
图 3:(a)8周龄野生型小鼠睾丸和Fbxo47基因敲除小鼠睾丸切片的H&E染色结果;(b)8周龄野生型小鼠和Fbxo47基因敲除小鼠睾丸切片的免疫荧光染色结果。标尺:50 μm
精子发生过程中重要的转录因子
精子发生过程具有很强的阶段特异性,在不同阶段中有着不同的转录特征,而转录因子被认为是在精子发生过程中调节了基因表达的时空特异性。
为了寻找调控精子发生关键转变节点的转录因子,该研究分别分析了有丝分裂向减数分裂转变过程和减数分裂向精子形成转变过程中的转录因子共表达调控网络。共表达网络结果显示,c-fos/c-jun和Zfp316在有丝分裂向减数分裂转变过程中具有潜在的调控作用(图4a)。而在减数分裂向精子形成转变过程中,除已报道的在生精细胞发育过程中发挥着重要功能的Crem和Rfx2外,该研究还筛选出像Sox30和Zfp541这样未知的潜在转录因子(图4b)。

图 4:有丝分裂向减数分裂转变(a)及减数分裂向精子形成转变(b)过程中的转录因子共表达调控网络。其中,黄色圆点表示各个转录因子,连线表示转录因子之间的关联
为了验证这些未知转录因子的作用,该研究对小鼠进行了Sox30基因的全局性敲除或生殖细胞特异性敲除。功能研究发现不论是全局性敲除的小鼠还是条件性敲除的小鼠,都表现为雄性不育。组织学H&E染色发现,Sox30基因敲除小鼠的精子发生表现为精子形成障碍,生精上皮内没有长形精子,少量的圆形精子细胞聚集形成多核巨型细胞。通过对顶体的染色,发现Sox30基因敲除小鼠的精子发生阻滞于圆形精子形成的第3~4步,提示Sox30基因在调控精子形成中的关键作用(图5a)。
为了探究Sox30调控精子形成的机制,研究人员从Sox30条件性基因敲除小鼠中获取了49个第3步圆形精子细胞用于单细胞转录组分析。Sox30基因敲除组和野生型对照组细胞内基因表达差异明显,存在两千多个差异表达基因(1,153个突变组下调基因和895个突变组上调基因)。通过对差异表达基因做GO分析发现,Sox30基因敲除组下调的基因与精子形成密切相关。为了进一步寻找受Sox30直接调控的下游靶基因,该研究开展了SOX30的ChIP-seq实验。通过与RNA-Seq的结果共同分析,在基因敲除组下调的基因中找到233个受Sox30直接调控的关键靶基因。通过GO分析发现,这些靶基因与精子形成密切相关,例如Chd5, Hils1和Sun5等(图5b)。
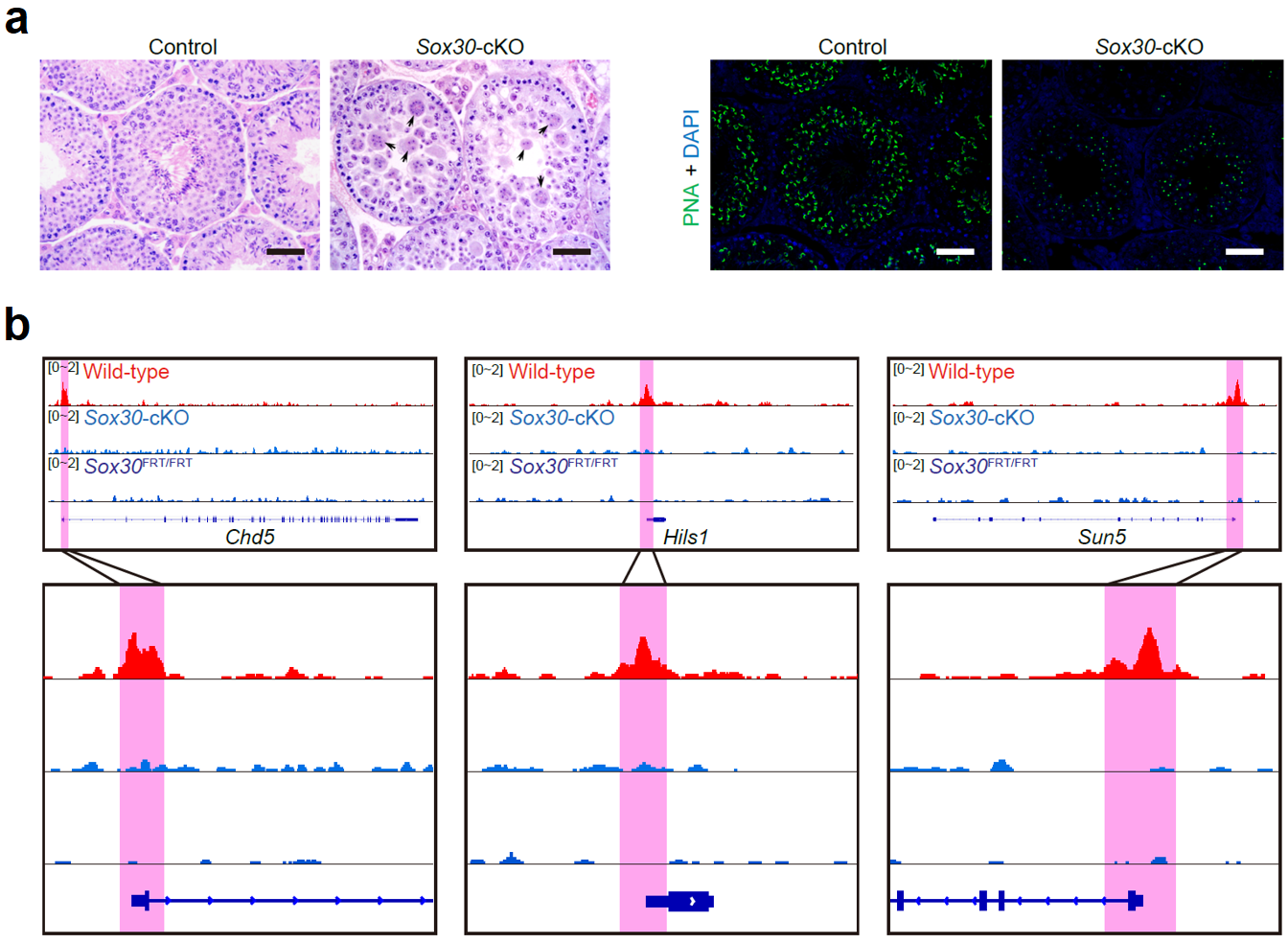
图 5:Sox30基因敲除阻碍了小鼠精子细胞的发育。(a)8周龄条件性敲除小鼠(Sox30-cKO)和对照组小鼠(control)的睾丸组织切片H&E染色和荧光染色结果,其中PNA标志着精子细胞的顶体;(b)野生型、条件性敲除、全局性敲除小鼠在3个代表性基因上ChIP-seq的结果。比例:50 μm
4. 第1~2步圆形精子相较于第7~8步圆形精子受精产生的胚胎具有较低的发育潜能
基于该研究建立的各级生精细胞的高精度转录组数据,研究人员筛选获取了特异性表达于不同发育阶段圆形精子的表面标志物,包括Cd37、Cd63、Cd96和Cd177等(图6a)。流式细胞分选实验证实了CD63阴性能够成功地富集第7~8步的晚期圆形精子细胞;而CD63强阳性则能够富集第1~2步的早期圆形精子细胞。这一实验结果提供了一种利用表面标志物分离获取不同发育阶段圆形精子细胞的策略。
为了观察不同发育阶段的圆形精子细胞是否与其授精后胚胎发育潜能相关,该研究进一步通过同步化方法及表面标志物分选的方法分别获取了早期圆形精子细胞和晚期圆形精子细胞,应用胞质圆形精子注射(Intracytoplasmic Round Spermatid Injection,ROSI)实验证实了晚期圆形精子细胞注射所得胚胎发育至囊胚的比率显著高于早期圆形精子细胞注射所得胚胎(图6b)。因此,第1~2步圆形精子相较于第7~8步圆形精子与卵细胞结合后产生的胚胎具有较低的发育潜能;提示人类临床上和动物实验上较低的ROSI成功率很可能是因为使用的圆形精子细胞中很大一部分是早期圆形精子而导致的。如果能够使用上述新发现的表面标志物将晚期圆形精子特异性富集出来用于ROSI,将有可能大幅度提高其成功率。
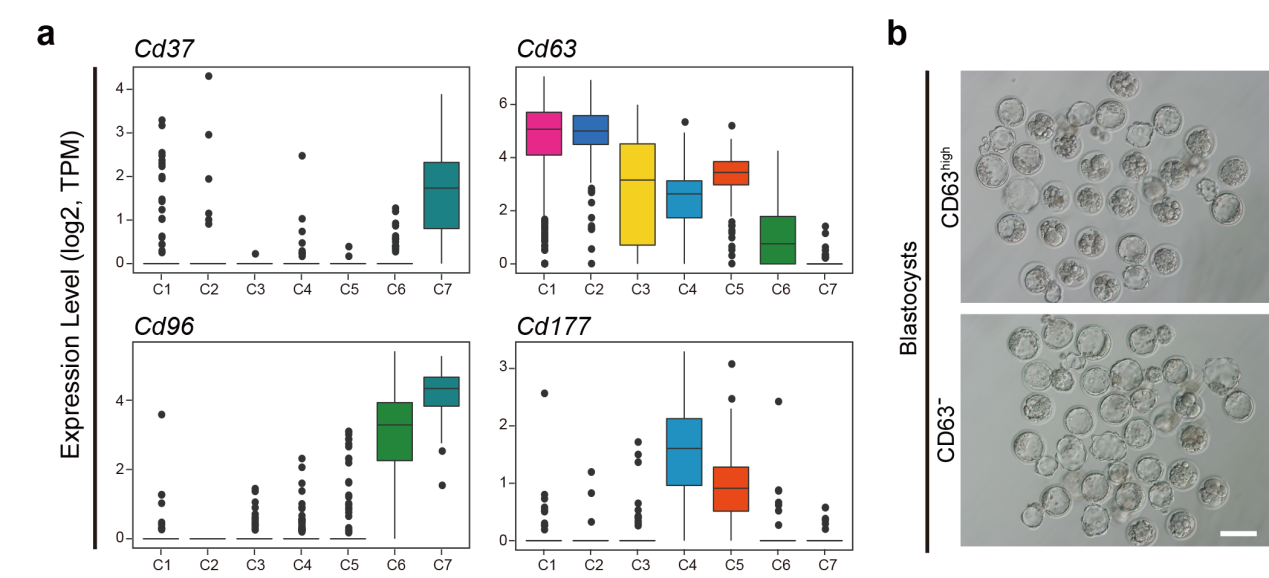
图 6:第1~2步圆形精子相较于第7~8步圆形精子具有较低的胚胎发育潜能
5. 精子发生过程中可变剪接的动态变化
在精子发生过程中会存在着大量的可变剪接事件。该研究通过对来自精子发生13个关键阶段的66个单细胞进行全长RNA-seq测序,结果发现可变事件在各阶段生精细胞内的分布情况与基因表达数目的动态变化极为相似,提示了可变剪接伴随着转录过程,是精子发生过程中转录后调控的重要表现形式(图7a)。同时,在该研究中还发现在各个阶段的生精细胞中,内含子滞留(intron retention)和外显子跳跃(exon-exon junction)类型的可变剪接事件始终是占比最高的可变剪接类型。
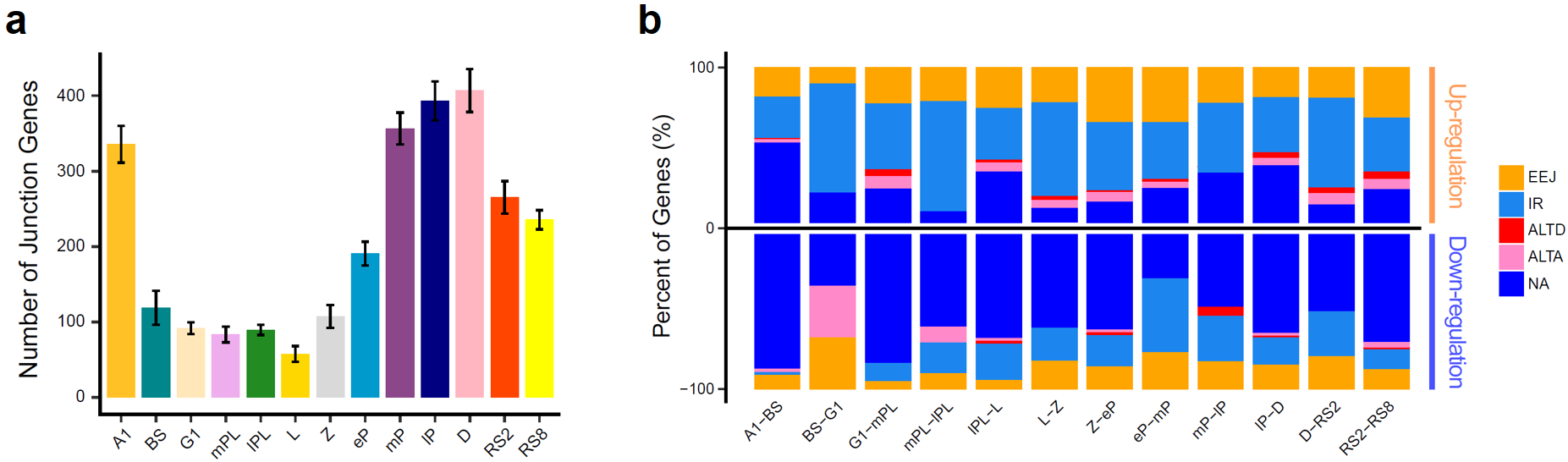
图 7:(a)柱状图展示了不同精子发生阶段中,每个细胞中至少含有2种可变事件的基因的平均数量;(b)堆积柱状图展示了相邻阶段差异基因和可变变化之间的关系
为了研究在相邻阶段之间发生变化的可变剪接事件,该研究将每个阶段的单细胞合并在一起,然后重新计算了每个阶段的可变剪接情况。结果发现,如果仅考虑两个阶段中至少有一个阶段存在可变剪接的情况,可以明显看到内含子保留是占比最高的可变剪接变化,这也就提示内含子保留可能是参与生精细胞转录后调控的重要手段之一。
为了观察可变剪接和基因表达之间的具体关系,该研究分析了相邻阶段之间差异基因的可变剪接变化。结果发现,当生精细胞从前一个阶段过渡到下一个阶段时,上调的差异基因更倾向于保留内含子而抑制表达,此时对应的RNA就会先储存起来而不进行蛋白质翻译。然而,下调的差异基因则更多的是转变为剪接成熟的转录本,这样的行为是有利于正常翻译使用的(图7b)。
6. 性染色体基因表达的动态变化
在精子发生过程中,性染色体上的基因有其独特的表达方式,即会发生减数分裂性染色体沉默(Meiotic Sex Chromosome Inactivation,MSCI)现象。然而由于受细胞纯度问题的困扰,对该现象的理解及其发生机制的研究一直不够深入。
该研究通过详细比较不同发育阶段生精细胞内性染色体基因表达的水平,详细归纳了不同基因的表达情况,并将这些基因划分成了MSCI PMSC、MSCI escape PMSC、escape MSCI等(图8a)。其中PMSC(Post Meiotic Sex Chromosome Inactivation)指的是减数分裂后性染色体相关基因不激活的状态,已有的观念认为,性染色体上基因在完成减数分裂后,仍旧处于转录抑制状态,此种现象称之为PMSC。同时,在该研究中发现不同性染色体基因的不同表达模式与其功能是密切相关的,例如escape MSCI的基因功能与染色质的重塑密切相关,提示这些基因可能参与了精子形成过程(图8b)。
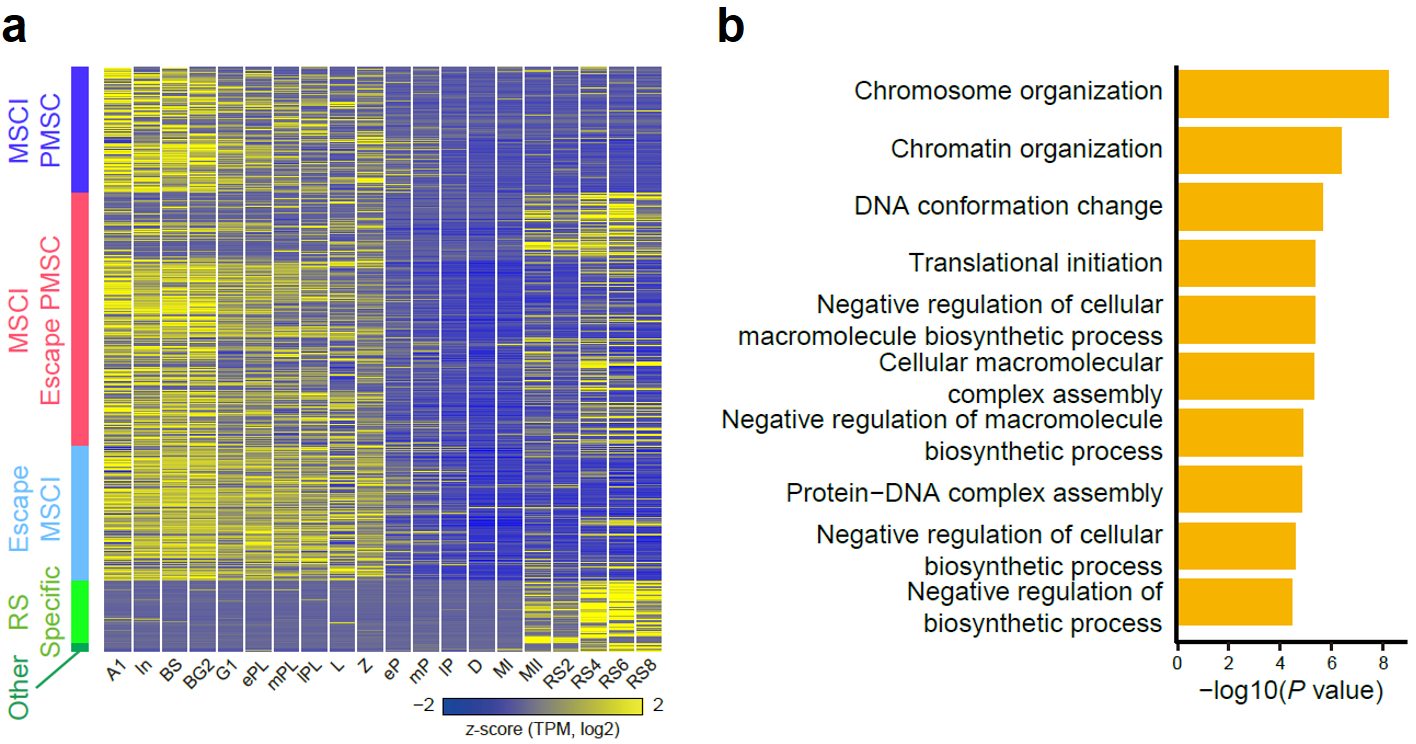
图 8:(a)热图展示了MSCI-PMSC、MSCI-逃逸PMSC、逃逸MSCI、RS特异性共5种类型的性染色体上基因在精子发生过程中的表达变化;(b)逃逸MSCI基因的GO富集分析结果
综上,该工作通过将精子发生同步化技术与单细胞转录组测序技术巧妙地结合起来,绘制了一幅高精度的小鼠精子发生转录组图谱,全面揭示了小鼠精子发生过程中基因表达的高度动态性与时空特异性,并在此基础上对发现的关键候选基因通过基因敲除和直接下游靶基因检测(ChIP-seq)等策略进行了深入的功能和机理研究,为后续全面研究精子发生调控机制提供了理论基础和宝贵资源,并对临床男性生殖障碍的诊疗提供了理论指导,为最终阐明哺乳动物精子发生的分子调控机制提供了可能途径。
北京大学北京未来基因诊断高精尖创新中心博士生郑宇轩和高云、中国科学院生物化学与细胞生物学研究所博士后陈瑶、博士生林震和杨苏明为该文章并列第一作者,北京大学汤富酬教授、中国科学院生物化学与细胞生物学研究所童明汉研究员和李劲松研究员为该文章的共同通讯作者。此项工作得到了中国科学院战略性先导科技专项、科技部(973计划)、国家重点研发计划、上海生科院基金、国家自然科学基金、上海市科委、北京未来基因诊断高精尖创新中心的支持。